- 发布时间:2024-05-27
“520”
可不只是浪漫日
还是一个更特殊的日子
“国际临床试验日”
临床试验日的起源
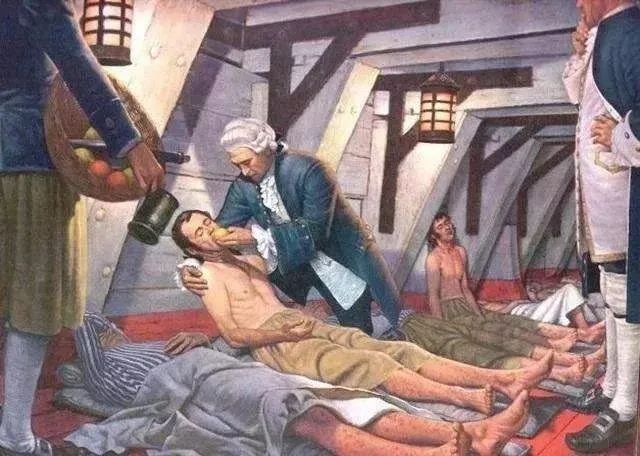
1747年5月20日,苏格兰海军军医詹姆斯·林德(James Lind)在索尔兹伯里号上选了12名坏血病船员,将他们分为六对,将新鲜柑橘和柠檬果汁纳入海员的饮食中,结果发现补充维生素C能够治疗坏血病。这就是著名的“坏血病临床试验”,它开启了现代临床试验的先河,为纪念这一历史性事件,欧洲临床研究基础网络(ECRIN)联合美国和加拿大,提议将每年的5月20日定为“国际临床试验日”。此后,每年举办此活动以引起公众重视临床研究的方法和挑战。
什么是临床试验?
药物临床试验,指以人体(患者或健康受试者)为对象的试验,意在发现或验证某种试验药物的临床医学、药理学以及其他药效学作用、不良反应,或者试验药物的吸收、分布、代谢和排泄,以确定药物的疗效与安全性的系统性试验。
医疗器械临床试验,是指在符合条件的医疗器械临床试验机构中,对拟申请注册的医疗器械(含体外诊断试剂)在正常使用条件下的安全性和有效性进行确认的过程。
临床试验作为获取有效循证医学证据的关键环节,是推动医学进步的重要手段。
参加临床试验是当“小白鼠”?
没有临床试验,药物、医疗器械等产品无法上市,也无法造福广大有需求的人群。
临床试验不是拿受试者“做小白鼠”,而是在有一定安全性保障的情况下进行:
1、临床试验只能在具备相应条件并按国家规定备案的临床试验机构开展;
2、临床试验开展前,必须经过伦理委员会审查,对试验可能带来的风险及受益进行评估,伦理委员会同意并得到批件后,才会允许开展相关临床试验;
3、进入临床试验前,受试者都要经过充分的知情并签署知情同意书;
4、临床试验过程中,受试者可以无理由退出临床试验,其医疗待遇与权益也不会受到影响。
机构简介:
佛山市第二人民医院药物-器械临床试验机构于2020年始筹建临床试验机构,同年9月在医疗器械临床试验机构备案管理信息系统中完成备案(械临机构备202000094),成为有资质的医疗器械临床试验机构,并顺利通过广东省药品监督管理局的现场检查以及日常监督检查。
机构目前拥有包括眼科、心血管内科在内的7个备案专业组,并由8名临床经验丰富的主任医师作为主要研究者(PI)承接本专业相关的医疗器械/体外诊断试剂临床试验项目。
本机构负责全院临床试验的组织、协调、实施、监督工作。参照 GCP 原则,机构制定了一整套规范的管理制度、标准操作规程(SOP)和质量控制体系,充分保障临床试验运行的科学性和规范性。机构以项目为核心,为临床研究的高质量开展提供立体化全方位支撑,力求保证临床研究的实施效率与质量。
机构将竭力为申办方、CRO等提供优质、高效、严谨的服务,欢迎申办方、CRO等来院、电话(0757-88032029)、邮件(fsey_gcp_2022@126.com)等方式洽谈业务。同时,机构也将不定期发布受试者招募信息,欢迎符合条件且有意愿参加研究的广大市民朋友踊跃报名。
(编辑于2024年5月27日)




 粤ICP备05006830号
粤ICP备05006830号


